بازسازی و رشد استخوان به داخل دهانه های جانبی و کانال تو خالی ایمپلنت دندانی
چکیده
این مقاله بررسی میکند که آیا استخوان میتواند به داخل یک ایمپلنت فلزی رشد کرده و کیفیت و کمیت خود را در اوایل دوره پس از کاشت حفظ کند. 12 ایمپلنت دندانی پیچی تیتانیومی یک تکه (گروه کنترلی) و 12 ایمپلنت دندانی ترکیبی با دهانههای جانبی مارپیچی متصل به کانال درونی توخالی (گروه آزمایشی) پس از 2 ماه ترمیم بعد از استخراج به صورت دو طرفه در هر 4/1 از حوزههای P3, P4, M1 فک پایین 4 سگ از نژاد بیگل قرار داده شدند. برچسبهای فلورسنت استخوان جهت ارزیابی کمی بافتهای استخوانی به ترتیب در هفته دوم و چهارم دوره پس از کاشت استفاده شدند. سه ساختار کنترلی و ایمپلنت استخوانی هر حیوان از دو حیوان در هفتههای سوم و ششم بعد از ترمیم پس از کاشت تشریح شدند. نمونههای کلسیمزدایی نشده هر ساختار تحلیلی به ترتیب برای بافتشناسی جهت اندازهگیری تماس استخوان با ایمپلنت (BIC) و موضع سطحی استخوان (BA) و همچنین دندانهگذاری نانو و اسکن توسط میکروسکوپ الکترونی جهت ارزیابی ماژول ارتجاعی (E) و ترکیب استخوان پوشش دهنده ایمپلنت آماده شدند. مقدار زیادی بافت استخوانی جدید در سطح گروههای ایمپلنتی مشاهده شد. بافتهای استخوانی به آسانی در هفته سوم ترمیم پس از کاشت در دهانههای جانبی و کانال درونی توخالی ایمپلنت آزمایشی رشد میکنند. مقادیر E بافتهای استخوانی جدید به اندازه بافتهای استخوانی عادی رشد داشتند. نتایج بدستآمده نشان میدهد که ایمپلنت ترکیبی جدید میتواند به داخل معماری درونی رشد کند که این موضوع پایداری سامانه ایمپلنتی را با تقویت یکپارچگی ایمپلنت با سطح استخوان افزایش میدهد.
واژههای کلیدی: ایمپلنت دندانی ، بازسازی استخوان ، دندانهگذاری نانو
بقای طولانی مدت ایمپلنت های دندانی مجاور (ADI) در بیماران مبتلا به پیش دیابت برای مشاهده این مطلب کلیک کنید
A B S T R A C T
The current study examined whether bone can regenerate into an open space fabricated inside the metal implant and maintain its quantity and quality at the early post-implantation healing periods. 12 conventional one piece screw type titanium dental implants (control group) and 12 hybrid dental implants with spiral side openings
(0.58 mm wide) connected to hollow inner channel (experimental group) were bilaterally placed in each quadrant at the P3, P4 and M1 positions in mandible of 4 adult beagles following 2 months of post-extraction healing. Fluorescent bone labels to qualitatively evaluate newly formed bone tissues were administered at 2 and 4 weeks of post-implantation periods, respectively. 3 control and 3 experimental bone-implant constructs for each animal were dissected from 2 animals at each 3 and 6 weeks of post-implantation healing periods. Undecalcified specimens were prepared from each construct for histological analyses to measure bone-to-im- plant contact (BIC) and interfacial bone area (BA), and also for nanoindentation and scanning electron micro- scopy to assess elastic modulus (E) and composition of bone tissues surrounding the implants, respectively. A substantial amount of newly formed bone tissues were observed at the implant interfaces of both implant groups. Bone tissues successfully regenerate through the side openings and hollow inner channel of the experimental implant as early as 3 weeks of post-implantation healing. The E values of the newly formed bone tissues were measured comparable to those of normal bone tissues. The current results indicate that the new hybrid implant can conduct bone regeneration into the inner architecture, which likely improves stability of the implant system by enhancing integrity of implant with interfacial bone.
روش انجام ایمپلنت برای مشاهده این مطلب کلیلک کنید
- مقدمه
نرخ موفقیت عمل جراحی ایمپلنت بیش از %94 است که این امر باعث میشود سالانه بیش از یک میلیون عمل انجام شده و موارد بالینی افزایش یابد (چاریوا و همکاران، 2012؛ پیترسون و همکاران، 2014؛ گرینشتاین و کاوالرو، 2014). این نرخ موفقیت بالا زمانی تضمین میشود که کیفیت و کمیت استخوان محل جراحی جهت کاشت ایمپلنت مساعد باشد. هرچند، اکثر بیمارانی که نیازمند ایمپلنتهای دندانی هستند به دلیل مشکلات استخوانی دهان که دلیل استخراج اولیه دندان و در نتیجه نبود استخوان شده است، با کمبود استخوان روبرو هستند (گرینشتاین و کاوالرو، 2014؛ تونتی و همکاران، 2008). برای مثال، استخراج دندان و آتروفی ایجاد شده بر اثر تاخیر درمان میتواند باعث از دست دادن برآمدگی لثه درونی بالایی شود (وانگ و لنگ، 2012؛ هاروویتز و همکاران، 2012). از این رو تقاضای زیادی برای ایمپلنتی وجود دارد که بتواند همزمان با حفظ پایداری خود تاثیر کیفیت و کمیت استخوان اطراف ایمپلنت را کاهش دهد.
فرآیند پیوند استخوانی نیازمند قرارگیری مستقیم استخوان در سطح ایمپلنت بدون تماس با بافت نرم است (برونسکی، 1988؛ برینمارک و همکاران، 1977؛ باسهارت و همکاران، 2017). علاوه بر پیوند استخوانی در سطح ایمپلنت، بازسازی و رشد استخوان به درون ایمپلنت دندانی توخالی نیز معرفی شد که میتواند ثبات سامانه ایمپلنتی را افزایش دهد (ساکاچی، 2000). مشاهده شد که استخوان در حفرههای عرضی دیوارههای استوانهای پیکره توخالی داخلی رشد میکند (پیاتلی و همکاران، 1999؛ تاکشیتا و همکاران، 1996). نرخ بقای این سامانه ایمپلنت دندانی توخالی بیش از %85 است (تلمن و همکاران، 2006؛ کاروسیس و همکاران، 2004). هرچند، این سامانه ایمپلنت توخالی با خطر ساختاری کمثباتی جهت تحمل بار به دلیل داشتن حفرههای جانبی و استوانهای توخالی با کف باز پیکره ایمپلنتی روبرو است (بنکه و همکاران، 2002؛ هلم و همکاران، 2001؛ بوسر و همکاران، 1997).
اخیرا، ایمپلنت دندانی جدیدی با دهانههای جانبی مارپیچ متصل به کانالهای داخلی توخالی و دهانههای بالایی تولید کردهایم (شکل 1). این ایمپلنت ترکیبی از شیار بالایی، دهانههای جانبی به شیارها در قسمت میانی و کف بسته شده با قسمت شیار پایینی تشکیل شده است. فرضیه ما این است که این معماری ترکیبی از شیارها و دهانهها میتواند باعث رشد درونی موفقیتآمیز استخوان به فضای داخلی شده و ثبات مکانیکی سامانه ایمپلنت دندانی را افزایش دهد. از این رو هدف مقاله پیش رو بررسی این موضوع است که آیا استخوان میتواند به داخل فضای ساخته شده در ایمپلنتهای فلزی رشد کرده و کیفیت و کمیت خود را در اوایل دوره ترمیم پس از کاشت حفظ کند.
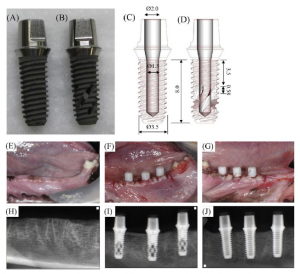
شکل 1. (A) ایمپلنتهای دندانی تیانیومی یک تکه مرسوم (گروه کنترلی) و (B) ایمپلنتهای دندانی ترکیبی یک تکه با دهانههای جانبی مارپیچ (گروه آزمایشی)، (C) طرحهای مهندسی هر طرح ایمپلنت، (D) دهانههای مارپیچ متصل به کانالهای درونی توخالی (واحد: mm). عکسهای بالینی (پانل بالایی) و رادیوگرافی (پانل پایینی) فرآیند کاشت. (E)، (H) محل استخراج پس از 8 هفته از ترمیم پس از کاشت. (F)، (I) ایمپلنتهای آزمایشی، (G)، (J) ایمپلنتهای کنترلی.
- مواد و روشها
2.1. مدل حیوانی
چهار سگ بالغ از نژاد بیگل با وزن 12-10 کیلوگرم (12 ماهه)در این مقاله استفاده شدهاند. تمامی حیوانها دندانهای کاملی داشتند. پروتکل تحقیقات حیوانی توسط موسسه منابع حیوانی آزمایشگاهی دانشگاه ملی سئول تایید شده است (SNU-170414-13).
2.2. ایمپلنتهای دندانی
از ایمپلنتهای دندانی تیتانیومی یک تکه (3.5 mm قطر و 8 mm طول) با کانالهای توخالی داخلی با سطحی مستحکم و حکاکی شده با اسید (SLA) (شینهونگ، سئول، کره) به عنوان گروه کنترلی در آزمایشات حیوانی استفاده شدند (شکل 1 A,C). سپس ایمپلنتهای دندانی ترکیبی با اصلاح ایمپلنتهای دندانی مرسوم جهت داشتن دهانههای جانبی مارپیچ متصل به کانال درونی توخالی به عنوان گروه کنترلی تولید شدند (شکل 1 B,D). بعد (0.58 mm طول) دهانههای جانبی مارپیچ با اشاره به مقالات قبلی مشخص میشود که از رشد داخلی استخوان در ایمپلنتهای تیتانیومی پرمنفذ (اندازههای منفذ 0.309، 0.632 و 0.956 mm) استفاده میکنند (تانیگوچی و همکاران، 2016). در نتیجه تحقیقات انجام شده نشان میدهد که ایمپلنتی با منفذ 0.632 mm بیشترین قدرت مکانیکی، ثبات بالا و رشد درونی سریع دو هفتهای پس از کاشت را ارائه میدهد. بسیاری از مقالات دیگر نیز از ایمپلنتهای فلزی منفذدار با اندازهای بین 0.5 mm و 0.7 mm استفاده کردهاند که رشد درونی قابل توجهی به داخل منفذ دشاتهاند (وانگ و همکاران، 2017؛ شاه و همکاران، 2016).
2.3. فرآیند جراحی
حیوانات تحت بیهوشی کلی قرار گرفته و محل جراحی نیز با لیدوکائین هیدروکلرید %2 و 1:100000 اپینفرین بیحس شد (لینسوپان، فرانسه). تمامی دندانهای آسیا و آسیای کوچک (P1-M1) به صورت دوطرفه کشیده شدند (شکل 1 E,H). بعد از 2 ماه دوره ترمیم پس از استخراج، ایمپلنتهای دندانی طبق مدل split-mouth به صورت دوطرفه در هر 4/1 از مواضع P3, P4, M1 فک بالا قرار داده شدند (شکل 1 F,G,I,J). پس از کاشت، یک پیچ مجاورتی در دهانه بالایی متصل به کانال درونی توخالی هر ایمپلنت قرار داده شد. سپس از یک سرپوش ترمیمی مخصوص پلاستیکی جهت پوشش قسمت مجاورتی ایمپلنت دندانی یک تکه استفاده شد که قسمت بالایی بافت نرم لثه را به نمایش میگذارد. از برچسبهای استخوانی فلورسنت جهت ارزیابی کیفی استخوان تازه تشکیل شده و بازسازی ایمپلنتهای مجاور استفاده شد. از زیلنول نارنجی (سیگما سن لولئیس، MO) و کالسین سبز (سیگما سن لولئیس، MO) به ترتیب در هفته دوم و چهارم دوره پس از کاشت استفاده شد (شکل 2). دو حیوان در هفته سوم و دو حیوان باقیمانده در هفته ششم پس از کاشت فدا شدند.
2.4. توموگرافی میکرو محاسبه شده (میکرو CT)
فک پایین توسط اره الماسی و داخل مایع به صورت بلوکی برداشت شدند (EXAKT، نوردرستد، آلمان). فکها داخل بفر فرمالین خنثی %10 قرار داده شده و بوسیله تعدادی محلول اتانول و با افزایش غلظت خشک شدند. سپس، بلوکها داخل فیلمهای رزین قرار داده شده و توسط میکرو-CT (SkyScan1172-D، کونتیچ، بلژیک) با وکسل μm3 16× 16×16 در شرایط یکسان اسکن 100 kV، 100 μA، 0.4 درجه چرخش در هر تابش، 5 فریم در هر تابش و زمان نمایش 885 ms اسکن شدند. تصاویر اسکن شده با همان اندازه وکسل بازسازی شدند. حوزه سطحی ایمپلنت و استخوان تا 300 μm از سطح ایمپلنت با استفاده از نرمافزار تصویربرداری جدا شدند (تصویر J، NIH) تا تصویری سه بعدی از بافت استخوانی التیام یافته اطراف ایمپلنت آزمایشی بدست آید (شکل 2G).
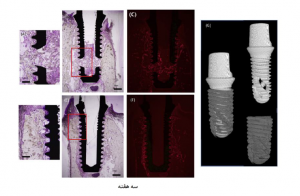
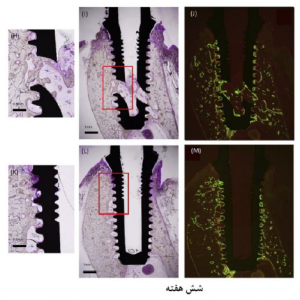
شکل 2. بافتشناسی سامانه ایمپلنت پس از سه و شش هفته از ترمیم پس از کاشت در گروههای آزمایشی (A) (B) (H) و گروههای ایمپلنت (L) (D) (E) (K). (A) (D) (H) (K) به ترتیب مناطق بزگنمایی شده کادرهای قرمز در (B) (E) (I) (L) میباشند. (C) (F) (J) (M) تصاویر فلورسنت بافتهای استخوانی تازه تشکیل شدهای هستند که در مدت دو هفته با زیلنول نارنجی (قرمز) و در مدت چهار هفته پس از کاشت با کالسین (سبز) ، علامتگذاری شدهاند. (G) تصویر Micro-CT بافت استخوانی ترمیم شده 300 μm دربرگینده ایمپلنت آزمایشی در هفته سوم. ایمپلنت و استخوان به صورت دیجیتالی از هم جدا شده اند.
2.5. بافتشناسی و تحلیل هیستومورفومتریک
ایمپلنت استخوانی کلسیمزدایی نشده در رزین در جهت دهان-زبان به صورت عرضی تشریح شده و با استفاده از یک سامانه برش و آسیاب به ضخامت نهایی کمتر از μm 50 رسیدند (EXAKT Apparatebau، نوردرستد، آلمان). تمامی فرآیندها با آب انجام شدند. نمونههای تشریح شده توسط محلولهای مختلف رنگآمیزی شدند (Polyscience آمریکا) (شکل 2). در هر دو گروه کنترلی و ایمپلنت آزمایشی، تماس ایمپلنت با استخوان (BIC, mm) در امتداد خط شیار ایمپلنت (شکل 3A، خط زرد) اندازهگیری شد، و حوزه سطحی ایمپلنت-استخوان (BA, mm2) نیز به عنوان حوزه پایینی نوک شیار و خط شیار بعدی بین شیارهای ایمپلنت شناخته شده است (شکل 3B، حوزه سبز). در گروه ایمپلنت آزمایشی، BIC و BA دهانههای جانبی و کانالهای پایینی پیچ نیز در امتداد خطوط داخلی (شکل 3A، خط قرمز) و به عنوان بافتهای استخوانی درون ایمپلنت اندازهگیری شدند. درصد BIC (BIC(%)) با محاسبه نسبت BIC به طول خط شیار و درصد BA (BA(%)) نیز با نسبت BA به حوزه کلی شیار بدست آمد. BIC (%) و BA (%) رشد درونی استخوان به داخل دهانههای جانبی و کانالهای داخلی توخالی با استفاده از نسبت BIC به طول کلی خطوط سطحی و نسبت BA به حوزه کلی زیر پیچ محاسبه شدند.
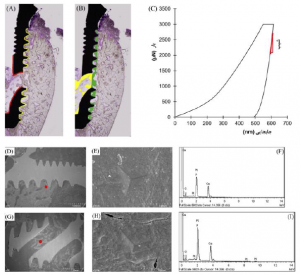
شکل 3. نمای شماتیک مناطق اندازهگیریشده برای تحلیل هیستومورفومتریک. مناطق اندازهگیری (A) تماس استخوان با ایمپلنت (BIC) و (B) حوزه سطحی استخوان-ایمپلنت (BA) که با خط زرد مشخص شده است: طول کلی سطح ایمپلنت، خط قرمز: طول کلی دهانههای جانبی و کانال درونی توخالی، منطقه سبز: حوزه استخوانی تازه تشکیلشده مجاور شیار، منطقه زرد: منطقه استخوانی تازه تشکیل شده در دهانههای جانبی و کانال درونی توخالی (رشد درونی). (C) شیب جابجایی باردندانهگذاری نانو استفاده شده برای ماژول کاهشیافته (Er). اسکن تصاویر میکروسکوپ الکترونی (sem) (d)سطح مجاور ایمپلنت و استخوان خارج از شیارها، (g) درون دهانههای جانبی همان سامانه ایمپلنت آزمایشی، و (e) (h) اشکال هرمی بافت استخوانی (نقطه قرمز در (d) و (g)). (f) (i) تحلیل طیف سنجی پراکندگی انرژی (eds) تصاویر sem مناطق دندانهگذاری نانو. غلظت بالای کلسیم (cA) و فسفر (p) نشانگر تشکیل بافت استخوانی جدید در مجاورت سطح فلزی ایمپلنت میباشد. اوج پلاتینیوم (pt) از فرآیند پوششی سطح نمونه ایجاد میشود.
2.6 دندانهگذاری نانو
نمونههای بدستآمده به غیر از موارد بافتشناسی پس از جلا دادن با خمیر الماس 1μm و جلادهندهای کند تحت دندانهگذاری نانو قرار گرفتند (بولر، لیک بلاف،IL). در کل 12 ساختار ایمپلنت-استخوان که شامل سه نمونه از هر گروه کنترلی و ایمپلنت آزمایشی در هفته سوم و ششم پس از کاشت موفقیتآمیز میشود، جهت دندانهگذاری نانو معرفی شدند.
مقادیر ماژول ارتجاعی (E) بافت استخوانی قبل از کاشت و رشد درونی به داخل ایمپلنت با داخل کردن نوک دندانهگذار هرمی الماس بکروویچ اندازهگیری شدند (Ubi-1، هیسیترون، مینیاپولیس، MN). دندانهگذار با کنترل بار نرخ کنترلی 300 μN/s و با پیک بار 3000 μN اداره شد. طیف عمق ورود بار524.25 ± 108.7 nm بود. در طی فرآیند خالی کردن بار پس از نگه داشتن آن به مدت 30 ثانیه، ماژول ارتجاعی دندانهگذاری نانو (E) از طریق معادله زیر (1) بدست آمد (الیویر و فار، 2004).

Er (ماژول کاهش یافته) از شیب فشار-جابجایی بدست میآید. Es ماژول ارتجاعی (E) نمونه و v نشانگر نسبت پویسون است. در دندانهگذار الماسی معمولا از مقادیر Ei=1141 GPa و vi = 0.07 استفاده میشود. نسبت پویسون استخوان 0.3 قرار داده شد.
دندانهگذاری در سطح بافت استخوان مجاور شیار ایمپلنت (منطقه سبز (BA) در شکل 3B) و بافت استخوانی موجود (μm300<) ایمپلنت (قبلی) گروههای کنترلی و ایمپلنت آزمایشی انجام شد. در گروه آزمایشی، دندانهگذاریهای اضافی برای بافتهای استخوانی جدید رشد یافته در دهانههای جانبی و کانالهای داخلی توخالی زیر پیچ (رشد درونی) انجام شد (منطقه زرد(BA) در شکل 3B). مناطق دندانهگذاری با مقایسه تصاویر ساختارهای ایمپلنت-استخوان مشخص شدند، که توسط میکروسکوپ نوری دندانهگذار نانو و میکروسکوپ فلورسنت جهت شناسایی بافتهای استخوانی تازه تشکیل شده در دوره ترمیم پس از کاشت ثبت شدهاند (شکل 2CFJM).
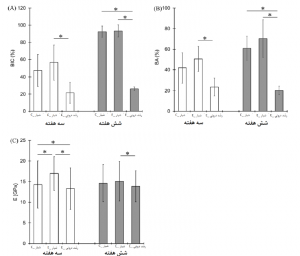
شکل 4. مقایسه (A) درصد تماس استخوان با ایمپلنت (BIC(%))، (B) مناطق سطحی ایمپلنت و استخوان (BA (%))، (C) ماژول ارتجاعی دندانهگذاری نانو، (E) مقادیر مناطق مختلف در هفتههای سوم و ششم. p < 0.031
2.7. میکروسکوپ الکترونی اسکن انتشار میدانی (FE-SEM)
جهت تایید یافتهها، تصویربرداری توسط FE-SEM (S-4700، هیتاچی، توکیو، ژاپن) مجهز شده به طیفسنج اشعه x توزیعکننده انرژی (EDX) انجام شد (EMAX H7200، هوبیرا کیوتو، ژاپن). نمونهها جلا داده شده و به مدت 120 ثانیه تحت پوشش پلاتینیومی قرار گرفتند. شرایط عملیاتی FE-SEM در انرژی نوری الکترونی 10 kV قرار داده شد. پردازش دیجیتال تصویر و تحلیلها در مناطق دندانهگذاری انجام شدند (شکل 3D-1).
2.8. تحلیل آماری
مقاله پیش رو 12 ساختار کنترلی و 12 ساختار ایمپلنت آزمایشی (3 ایمپلنت دندانی کنترلی و آزمایشی از هر حیوان) از دو حیوان در هفته سوم و ششم دوره ترمیم پس از کاشت بدست آورده است. در کل 23 برش (5 مورد کنترلی و 6 مورد آزمایشی در هفته سوم، و 6 مورد کنترلی و 6 مورد آزمایشی در هفته ششم). در کل از 12 برش (3 مورد کنترلی و 3 مورد آزمایشی در هفتههای سوم و ششم) در امر دندانهگذاری استفاده شده است. همانطور که در مقالات قبلی نشان داده شده است مقادیر خطاهای اندازهگیری در فرآیند جستجوی سطح دندانهگذاری و دادههای خارج از محدوده آماری ، حذف شدهاند (هافلر و همکاران، 2000؛ کیم و همکاران ، 2010). از این رو، دادههای دندانهگذاری نانو کسب شده از 3552 مورد دندانهگذاری (748 شیار و 651 منطقه موجود برای گروههای کنترلی و 704 مورد رشد درونی، 783 شیار و 666 منطقه موجود برای گروه آزمایشی) در تحلیل فعلی گنجانده شدهاند. تحلیل دوطرفه و سپس آزمایش Tukey-Kramer Post hoc برای هر یک از متغیرهای وابسته (BIC(%))، BA (%)، و (E)در دوره پس از کاشت انجام شد (هفته سوم و ششم)، و مناطق مربوطه (رشد درونی، شیار، موجود) به عنوان متغیرهای مستقل در هر گروه ایمپلنتی (کنترلی و آزمایشی) قرار داده شدند. اهمیت آماری p < 0.05 میباشد.
- نتایج
تمامی موارد کاشتی با موفقیت انجام شده و هیچ مشکلی در دوره ترمیم پس از کاشت دیده نشد. بافتهای استخوانی تازه تشکیل شده در سطوح استخوان-ایمپلنت هر دو گروهها در هفته سوم و ششم دوره ترمیم پس از کاشت مشاهده شد (شکل 2). در گروه ایمپلنت آزمایشی، استخوان جدید با موفقیت توانست به دهانههای جانبی و کانالهای درونی توخالی رشد کند، که این موضوع باعث ایجاد پلهایی بین استخوانهای آلوئولار اطراف ایمپلنت شد. تصاویر میکروسکوپی فلورسنت به وضوح بافتهای استخوانی جدید قرمز مجاور به شیارهای ایمپلنتی را در هفته سوم و ترکیب بافتهای استخوانی قرمز و سبز را در هفته ششم دوره ترمیم پس از کاشت نشان میدهد. در گروه آزمایشی، بافتهای استخوانی تازه تشکیل شده در دهانههای جانبی و کانالهای داخلی نیز همانند مناطق شیاری برچسبگذاری شدند.
جدول 1مقایسه درصد BIC (%) و BA (%)، و ماژول ارتجاعی (E) مناطق مختلف موجود در گروههای کنترلی و ایمپلنت آزمایشی (شیار_C کنترلی و آزمایشی) در دوره پس از کاشت (هفته سوم و ششم). دادهها به صورت ± میانگین انحراف معیار هر پارامتر ارائه شدهاند.
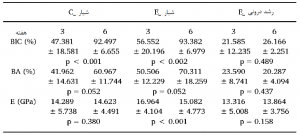
مقادیر BIC (%) وBA (%) مناطق شیاری تفاوت چندانی بین گروه کنترلی (شیار_C) و گروه آزمایشی (شیار_E) در هفته سوم و ششم (0.433 >P) (اشکال 3 و 4A,B) نداشتند، با وجود اینکه از هفته سوم تا ششم افزایش یافته بودند (0.053>P) (جدول 1). منطقه رشد درونی (رشد درونی_E) BIC (%) و BA (%) بسیار کمتری نسبت به شیار (شیار_E) مناطق گروه آزمایشی در هفته سوم و ششم (0.027>P) داشت، در حالی که این مقادیر در هفته سوم و ششم تفاوت چندانی نداشتند (0.437>P). مقادیر BIC (%) و BA (%) تفاوت چندانی بین شیار_E و رشد درونی_E در هفته سوم (0.126>P) نداشتند، در حالی که منطقه رشد درونی_E در هفته ششم مقدار بسیار کمتری نسبت به منطقه شیار داشت (0.001>P).
مناطق موجود (4.622 GPa±18.925) مقادیر (E) ماژول ارتجاعی بسیار بیشتری نسبت به سایر مناطق مستقل از گروههای ایمپلنتی و دورههای پس از کاشت (0.001>P) داشتند. مقادیر E مناطق شیار_E بسیار بیشتر از مناطق شیار_C بودند (0.001>P) در حالی که این مقدار برای رشد درونی_E بسیار کمتر از هر دو منطقه شیاری در هفته سوم بود (0.031>P) (شکل 4C). منطقه رشد درونی_E مقادیر E بسیار کمتری نسبت به منطقه شیار_E (0.003=P) داشت، در حالی که تفاوت چندانی با شیار_C در هفته ششم نداشت (0.099= P). غلظت بالای کلسیم (Ca) و فسفر (P)، که ترکیبات اصلی استخوان میباشند، در مناطق دندانهگذاری نانو در هفته سوم پس از کاشت شناسایی شدند (شکل 3F,1). نسبت % اتمی Ca/P در شیار_E، رشد درونی_E و مناطق موجود به ترتیب 1.42 (14.42/20.27)، 1.37 (13.97/19.13)، و 1.65 (18.2/30.12) میباشند.
- بحث
ایمپلنت دندانی ترکیبی جدید به نوعی طراحی شده است که دهانههای جانبی استوانهای و کانالهای داخلی توخالی را ترکیب کند، که باعث رشد درونی استخوان به داخل ایمپلنت میشود. دهانههای جانبی از قسمت میانی ایمپلنت دندانی پیچی مرسوم به داخل شیارها سوراخ میشوند. از این رو، این طرح مفهومی را میتوان در هر ایمپلنتی به کار برد. شیارهای قسمت بالایی در تماس با منطقه استخوانی پریوستئال میتوانند باعث ثبات سامانه ایمپلنت ترکیبی شوند که مانند سامانه ایمپلنتی در شرایط اولیه بارگذاری است. رشد درونی استخوان در فضای داخلی ایمپلنت ترکیبی با تماس استخوان با سطوح ایمپلنتی در طول شرایط بارگذاری باعث تقویت ثبات اولیه میشود. همچنین، شیارهای کف بسته موجود در قسمت میانی و پایینی برای ارائه قدرت بالای مکانیکی به ایمپلنت و افزایش تحمل بار آن و تقویت تماس ایمپلنت با استخوان طراحی شدهاند. از این رو، این ترکیبات معماری جدید به خطر احتمالی عدم ثبات ایمپلنتهای توخالی پیشین غلبه میکنند، که از ظروف توخالی استوانهای کف باز تشکیل شدهاند. با اینکه قسمت شیار بالایی در مطالعات حیوانی فعلی 3.5 mm میباشند، پیشنهاد میشود که این اندازه جهت اجتناب از خسارت به استخوان به 4 mm تغییر یابد (کیم، 2017؛ استانداردسازی، 2007). به علاوه، از آنجایی که کانال داخلی به دهانه بالایی و جانبی متصل است، میتوان از دارودهی محلی جهت تقویت بازسازی و رشد استخوان به سمت فضای آزاد بهره برد. تمرکز مقاله فعلی بر روی تایید کاربرد این ساختار ترکیبی در افزایش یکپارچگی پیکره ایمپلنتی با بافت استخوانی رشد یافته در داخل و سطح ایمپلنت است.
همانطور که با برچسبهای فلورسنت دیده میشود بافتهای جدید استخوانی به طور مداوم در مناطق شیاری با ترمیم پس از کاشت طولانی افزایش یافتند (شکل 2). استخوان سطحی مجاور شیارها به دلیل جراحیهای شدید کاشت آسیب دیدهاند (باسهارت و همکاران، 2017؛ اینسوا و همکاران، 2017). بازده فعال استخوان با تعویض استخوان آسیب دیده با استخوان اولیه و سپس با استخوان بالغ ثانویه تحریک میشود. جذب استخوانی پس از کاشت در مدل حیوانی حدود دو هفته به طول میانجامد (برگلاند و همکاران، 2003؛ باسهارت و همکاران، 2017). طول مدت چرخه بازسازی استخوان که شامل فعالسازی و جذب و سپس تشکیل میباشد در سگها حدود 12 هفته است (گرتو و همکاران، 1995). این مشاهدات در مقاله پیش رو به این معنی هستند که، قرارگیری بافتهای استخوانی جدید در شیارها باعث افزایش تماس استخوان و ایمپلنت و ترمیم 6 هفتهای پس از کاشت میشود.
عجیبترین یافته این مقاله بافتهای استخوانی جدید رشد یافته در دهانههای جانبی و اتصال یافته به کانال درونی توخالی در هفته سوم ترمیم پس از کاشت میباشد (شکل 2). بافتهای استخوانی ترابکولار در دهانههای جانبی و کانالهای داخلی شبیه تشکیل استخوان میباشد، که از استخوان سطحی اطراف ایمپلنت رشد میکند. در حالی که بافتهای استخوانی جدید در فضاهای داخلی در هفته سوم دیده میشود، تماس ایمپلنت با استخوان و مناطق مختلف افزایش چندانی نداشته و تا هفته ششم حفظ شدند. قبلا اظهار شده است که سطح تماس بالای استخوان ترابکولار جهت تقویت بازده استخوان دسترسی بیشتری برای سلولهای استخوانی دارد (سیمن، 2013؛ آلن و همکاران، 2011). همانند معماری ترابکولار، فضای باز داخلی ایمپلنت ترکیبی باعث تقویت رگزایی و اکسیژنرسانی و ارائه متابولیت جهت بکارگیری سلولهای استخوانی برای افزایش بازده استخوان بدون تغییر مقدار استخوان میشود. به مطالعات بیشتری نیاز داریم تا آنژیوژنهای درگیر در بازسازی و رشد استخوان و فضای باز داخلی که نهایتا با استخوان پر میشود را بیابیم.
مقادیر بسیار کم (E) ماژول ارتجاعی دندانهگذاری نانو بافتهای استخوانی سطحی موجود نشان میدهد که بافتهای استخوانی سطحی تازه تشکیل شده، محتوای معدنی کمتری دارند. بازسازی فعال بافت استخوانی جدید رشد یافته به داخل فضای باز داخلی باعث ایجاد بافتهای استخوانی با محتوای معدنی و مقادیر(E) کمتر میشود. قبلا اشاره شده است که بلوغ استخوان ترابکولار در سطح ایمپلنت را میتوان پس از 8 هفته ترمیم بعد از کاشت مشاهده کرد (باسهارت و همکاران، 2017). هرچند، در این مقاله مشاهده کردیم که بافتهای استخوانی تازه تشکیل شده قدرت برابری با بافتهای استخوانی عادی داشته و مقادیر (E) بالاتری از 5 GPa مستقل از دوره ترمیم پس از کاشت داشتند. یک یافته قابل توجه این است که مقادیر E مناطق شیاری ایمپلنت ترکیبی در هفته سوم ترمیم پس از کاشت بسیار بیشتر از مناطق شیاری گروه کنترلی بودند (شکل 4C). این نتایج به این معنی است که فضاهای باز به ترکیبات معدنی بافتهای استخوانی سطحی جدید مجاور دهانههای جانبی در مراحل اولیه یکپارچهسازی استخوانی کمک میکنند.
نسبت اتمی % Ca/P شیار_E و رشد درونی_E بسیار کمتر از مناطق موجود بودند. این نتایج با مقادیر کمتر E دندانهگذاری نانو اندازهگیری شده در شیارها و مناطق رشد درونی نسبت به مناطق موجود، همخوانی دارند. اظهار کردهایم که بازده فعال استخوان در سطح ایمپلنت-استخوان باعث ایجاد بافتهای استخوانی جوانتر میشود که باعث ایجاد ویژگیهای مکانیکی کمتر استخوانهای سطحی نسبت به استخوانهای موجود جدا از ایمپلنت با روشهای درمانی و دورههای ترمیم پس از کاشت متفاوت (کیم و همکاران 2016b) و بازسازی و رشد استخوانی هدایت شده (جانسون و همکاران 2018) مناطق مستقل دهانی و زبانی میشود. همچنین مشاهده شد که بافتهای استخوانی سطحی در ایمپلنتهای منفذدار ویژگیهای بالغ کمتری داشتند (شاه و همکاران، 2016، 2019). ایمپلنت منفذدار Ti6AI4V توسط چاپگر سه بعدی و تکنیک ذوب نوری الکترونی (EBM) تولید شده و در اپیفیز استخوان ران گوسفند قرار داده شد. بافتهای استخوانی سطحی مجاور سطوح نرم ایمپلنت رشد یافته داخل سطح منفذدار EBM نسبت % اتمی Ca/P کمتر و محتوای ارگانیک، کانالهای استخوانی در هر حفره استخوانی و چگالی استخوانی بیشتری نسبت به بافتهای استخوانی محلی بودند. این مشاهدات مدرن بر مبنای اسکن میکروسکوپ الکترونی نشانگر این میباشند که بافتهای استخوانی جدید ترکیباتی جوانتر در سطح ایمپلنت-استخوان و داخل منافذ ایمپلنت دارند. از سوی دیگر، بارگذاری مشبک به طور مداوم با حفظ ثبات مکانیکی سامانه ایمپلنت باعث تحریک بازسازی فعال استخوان سطحی تا 5 سال پس از ترمیم کاشت میشود (بالداساری و همکاران، 2012؛ پیاتلی و همکاران، 2014). بافتهای استخوانی با محتوای معدنی کم و محتوای ارگانیک بالا ویژگیهای ایستا و ویسکوالاستیک پویای وابسته به زمان بیشتری دارند (کیم و همکاران، 2015؛ 2016b؛ لس و همکاران، 2004؛ ویگوئت کارین و همکاران، 2006). از این رو، این نتایج شناختی ارائه میدهند که، بافتهای استخوانی سطحی جدید مزایایی در جذب و توزیع انرژی بارگذاری در سامانههای ایمپلنتی دارند، و این موضوع نقش مهمی در موفقیت بلندمدت سامانه ایمپلنتی دارد. تحقیقات آتی میبایست روابط بین تغییرات ترکیبی و ساختاری بافتهای استخوانی سطحی و ثبات مکانیکی سامانه ایمپلنتی را ارزیابی کنند.
از این رو، محدودیت این مقاله این است که ثبات مکانیکی سامانه ایمپلنتی ارزیابی نشده است. به طور قطع مشخص نشده است که آیا رشد درونی استخوان باعث تقویت قدرت تحمل بار ایمپلنت ترکیبی در مقایسه با ایمپلنت کنترلی پیچی مرسوم میشود. هرچند، یافتههای فعلی اهمیت کمیت و کیفیت بازسازی و رشد استخوان در فضای باز داخلی و همچنین قرارگیری استخوان در سطوح ایمپلنتی مجاور شیارها را تایید میکنند که عوامل مهمی جهت حفظ ثبات سامانه ایمپلنتی در بارگذاری میباشند. یک محدودیت دیگر این است که نتایج فعلی بدون بارگذاری داخلی در سامانههای ایمپلنتی بدست آمدهاند. مشاهده شده است که بارگذاری میتواند باعث تحریک بازسازی در سطح ایمپلنت شود (بالداساری و همکاران، 2012) اما تاثیرات آن بر رشد درونی استخوان در فضای داخلی ایمپلنت بررسی نشده است. تمرکز مقاله پیش رو بر فرآیند اولیه ترمیم پس از کاشت و پیش از بارگذاری عملی بوده است.
- نتیجهگیری
اندازه و معماری دهانههای جانبی مارپیچ و کانال درونی توخالی در قسمت میانی ایمپلنت دندانی ترکیبی یک تکه باعث رشد درونی استخوان در اوایل دوره ترمیم پس از کاشت میشود. بافت استخوانی جدید رشد یافته در فضای داخلی کیفیت قابل مقایسه با بافت استخوانی عادی داشت. کمیت استخوان جدید در قسمت شیار ایمپلنت ترکیبی شبیه کمیت ایمپلنت پیچی مرسوم بود. دهانههای جانبی نیز میتوانند باعث افزایش کیفیت بافتهای استخوانی جدید در اوایل دوره ترمیم پس از کاشت شوند. این نتایج مهر تاییدی بر تاثیرگذاری مفهوم فضای باز در ایمپلنتهای ترکیبی جدید به عنوان سکویی جهت رشد فعال استخوان میباشند. موارد بکارگیری آتی میتواند شامل دارودهی محلی از طریق حفره بالایی ایمپلنت ترکیبی جهت درمان لانهگزینی و تقویت بازسازی و رشد استخوان در مناطقی با استخوان کمتر، نقص حیاتی اندازه و بلند کردن سینوس باشد. با موفقیت این رویکردها، سامانه ترکیبی فعلی میتواند باعث گسترش مفهوم مرسوم یکپارچگی استخوانی شود.
برای دانلود کامل مقاله فارسی بازسازی و رشد استخوان به داخل دهانه های جانبی و کانال تو خالی ایمپلنت¬ دندانی اینجا کلیک کنید
برای دانلود کامل مقاله انگلیسی ( English ) بازسازی و رشد استخوان به داخل دهانه های جانبی و کانال تو خالی ایمپلنت¬ دندانی اینجا کلیک کنید